I composti di Elio possono davvero esistere?
(Experimenta et Hypotheses Chemica)
Non è facile rispondere a questa domanda o almeno nei termini in cui siamo abituati a vedere i legami chimici classici. Attualmente sono stati documentati alcuni composti chimici gassosi nobili, soprattutto Radon, Kripton, Xenon, Argon. I composti di elio e neon sono meno chiari.
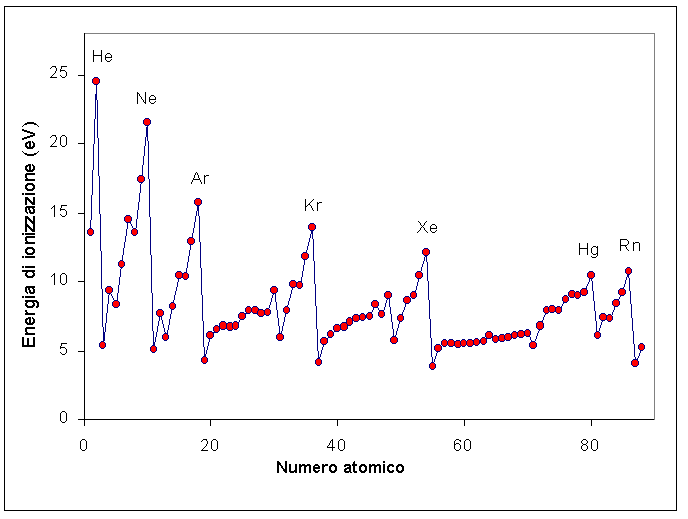
Figura 1: Energia di prima ionizzazione per tutti gli atomi fino al radio, grafico di Excel Autore: Svante. Di L’utente che ha caricato in origine il file è stato Svante di Wikipedia in italiano – Trasferito da it.wikipedia su Commons da Fale utilizzando CommonsHelper., CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=4725371
Dalla figura 1 è possibile osservare le energie di ionizzazione dei gas nobili con l’elio superiore a tutti i gas nobili. Sono stati ipotizzati composti di elio con tungsteno ed elio con mercurio, ma studi approfonditi hanno portato allo scarto di questa possibilità e alla conclusione che l’elio è assorbito dalle superfici metalliche. I clatrati (noti come composti della gabbia) hanno generato più interesse e sono noti con atomi di elio o argon intrappolati nel reticolo cristallino. Supponiamo di avere un reticolo di elementi con almeno un emettitore alfa e se la profondità del sistema è tale che la pressione è dell’ordine di GPa, la formazione del clato è plausibile, mentre se la pressione è inferiore il reticolo non è in grado trattenere internamente la particella alfa che è prima un nucleo di elio e successivamente un atomo di elio. Possiamo immaginare l’esistenza della molecola di elio diatomico?

Figura 2: Diagramme d’OM du dihélium – Par Adam Redzikowski — File:Diagramme H2.jpg, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=24649261.
Con due atomi di elio allo stato fondamentale non è possibile secondo la teoria degli orbitali molecolari [Figure 2], ma è possibile ottenere una molecola con due atomi eccitati (Eccimeri). È una molecola di Wan der Waals (He-He) formata da due atomi di elio osservati dal 1912 con metodi spettroscopici, interpretando lo spettro di elio [Figure 3] chiamata molecola di Rydberg con una lunghezza del legame di 5200 pm e con energia del legame circa 5000 volte più debole del legame

Figura 3: Spectral lines of helium. By NASA – http://imagine.gsfc.nasa.gov/docs/teachers/lessons/xray_spectra/worksheet-specgraph2-sol.html, Public Domain, https://commons.wikimedia.org/w/index.php?curid=4158610
H-H. Solo l’isotopo di elio (4) è in grado di formare questo tipo di molecola biatomica, mentre la molecola formata da due isotopi He (3) non esisterebbe. È anche nota la molecola triatomica degli isotopi He (4) resi plausibili dall’effetto Efimov. In campi magnetici molto elevati e temperature molto basse, gli atomi di elio si attraggono e possono formare catene lineari. A pressioni superiori a 100 GPa, un composto chiamato eliuro di disodio è stabile ed è presente un atomo di elio nel reticolo cristallino cubico di sodio. Potremmo chiederci cosa può fare per focalizzare le proprietà chimiche e fisiche dell’elio a pressioni molto elevate e temperature molto basse, in realtà tale conoscenza può essere utile per comprendere la geochimica degli elementi nei pianeti esterni come Plutone, Urano e Saturno tre pianeti di cui non conosciamo molto bene le dinamiche geochimiche.
Can helium compounds really exist?
It is not easy to answer this question or at least in the terms in which we are used to seeing classic chemical bonds. At present some chemical compound of noble gaseous have been documented, (Radon, Kripton, Xenon, Argon). Helium and neon compounds are less clear. From figure 1 it is possible to observe the ionization energies of elements with helium higher than all. Helium compounds with tungsten and helium with mercury have been hypothesized, but in-depth studies have led to the discard of this possibility and the conclusion that helium is absorbed by the metal surfaces. The clathrates (known as cage compounds) have generated more interest and are known with helium or argon atoms trapped in the crystal lattice. Suppose we have a crystal lattice of elements with at least one alpha emitter and if the system is such that the pressure is of the order of GPa, the formation of the clatrathe is plausible, while if the pressure is lower the lattice is unable to retain internally the alpha particle which is first a helium nucleus and subsequently a helium atom. Can we imagine the existence of the diatomic helium molecule? With two helium atoms in the ground state it is not possible according to the theory of molecular orbitals [Figure 2], but it is possible to obtain a molecule with two excited atoms (Excimer). It is a Wan der Waals (He-He) molecule formed by two helium atoms observed since 1912 with spectroscopic methods, interpreting the helium spectrum [Figure 3] called the Rydberg molecule with a bond length of 5200 pm and with energy of bond about 5000 times weaker than the HH bond. Only the helium isotope (4) is able to form this type of diatomic molecule, while the molecule formed by two He (3) isotopes would not exist. The triatomic molecule of the He (4) isotopes made plausible by the Efimov effect is known too. In very high magnetic fields and very low temperatures, helium atoms attract and can form linear chains. At pressures above 100 GPa, a compound called disodium heliide is stable and a helium atom is present in the cubic sodium crystal lattice. We could ask ourselves what it can do to focus the chemical and physical properties of helium at very high pressures and very low temperatures, in reality this knowledge can be useful to understand the geochemistry of the elements in the external planets such as Pluto, Uranus and Saturn three planets of which we don’t know geochemical dynamics very well.
Figura 1: Energia di prima ionizzazione per tutti gli atomi fino al radio, grafico di Excel Autore: Svante. Di L’utente che ha caricato in origine il file è stato Svante di Wikipedia in italiano – Trasferito da it.wikipedia su Commons da Fale utilizzando CommonsHelper., CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=4725371
Figura 2: Diagramme d’OM du dihélium – Par Adam Redzikowski — File:Diagramme H2.jpg, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=24649261.
Figura 3: Spectral lines of helium. By NASA – http://imagine.gsfc.nasa.gov/…/worksheet-specgraph2-sol.html, Public Domain, https://commons.wikimedia.org/w/index.php?curid=4158610
Fonti:
1. https://en.wikipedia.org/wiki/Helium;
2. https://en.wikipedia.org/wiki/Helium_compounds
3. https://fr.wikipedia.org/wiki/Dihélium
4. https://it.wikipedia.org/wiki/Energia_di_ionizzazione
Dr Riccardo Zanaboni (Esponente del Comitato Scientifico del C.I.R. Centro Italiano Ricerche)
By: Centro Italiano Ricerche
